
Non, la voiture à eau n’arrivera pas sur le marché l’année prochaine… En revanche, ils est fort possible que très bientôt, on soit en mesure de produire du carburant à partir de l’eau : l’hydrogène.
L’hydrogène, où, quand, comment ?
L’hydrogène est l’élément le plus abondant sur notre planète. Chaque molécule d’eau (et dieu sait qu’il y en a quelques-unes sur notre planète BLEUE…) est composée de 2 atomes d’hydrogène et d’un atome d’oxygène. L’hydrogène est également l’élément le plus simple et le plus léger, en plus d’être inodore, invisible, et non toxique !
Et cerise sur le gâteau, sa combustion ne produit aucune particule nocive (juste de l’énergie et de l’eau – propre !), et il est le plus efficace de tous les carburants à poids égal (d’ailleurs, c’est pas pour rien qu’on fait voler les fusées avec !).
« Mais c’est le Saint-Graal ton truc-là » vous allez me dire…
Oui, sauf que… bah pour l’instant, on le produit principalement à partir d’énergies fossiles, et qu’on est pas encore au top au niveau du stockage et du transport…
Production, production, production…
Le problème rencontré aujourd’hui avec l’utilisation de l’hydrogène comme carburant, c’est qu’on ne sait pas encore le produire de manière propre, sans utiliser d’énergies fossiles et à grande échelle, histoire d’en mettre dans tous les réservoirs !
Mais on est sur le coup ! D’ailleurs, en France par exemple, on a des start-up innovantes comme HySiLabs, qui développe de nouvelles solutions de transport de l’hydrogène, mais qui n’ont pas encore trouvé de solution de production propre et en masse!
Mais ce problème de production n’est pas passé inaperçu, et de nombreuses équipes de recherche planchent sur la question. C’est le cas d’une équipe du Laboratoire National d’Argonne aux Etats-Unis, qui vient de publier une étude au titre effrayant mais aux résultats fabuleux : produire de l’hydrogène et de l’oxygène, à partir d’eau, et en utilisant l’énergie solaire !
Entrons dans les détails
Promis, pas trop non plus ! Nos chercheurs sont partis du postulat que dans l’eau, on a des atomes d’hydrogène, et des atomes d’oxygène, et que donc il doit bien y avoir un moyen – propre ! – de découper tout ça pour en faire du dihydrogène (H2, son vrai nom) et du dioxygène (O2, c’est celui qu’on respire). C’est pas aussi simple que ça en a l’air hein, puisque la nature est bien faite et qu’on découpe pas comme ça les molécules, sinon ça serait le bazar !
Et justement, comme la nature est bien faite, dans certaines plantes, la photosynthèse fait déjà un peu ce travail : c’est ce qui est représenté dans un schéma qu’on appelle le schéma en Z, où un premier mécanisme oxyde l’eau via l’énergie solaire (photosystème 2), puis un second mécanisme agit sur le transfert d’électrons à travers les membranes cellulaires (photosystème 1). Me demandez pas pourquoi on les a numérotés dans ce sens là, c’est ainsi…
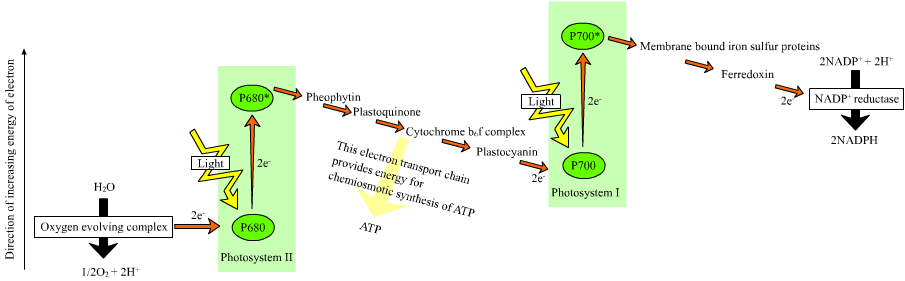
Bref, après tout ça, ces électrons sont utilisés pour former du NADPH, utilisé par la suite par les plantes pour fixer le CO2.
Nos chercheurs, justement, se sont dit que c’était peut-être là qu’il fallait agir, en redirigeant ces électrons pour former du dihydrogène à la place !
Et ça marche !
Mais c’est pas magique non plus !
Vous vous doutez bien qu’il n’a pas simplement fallu mettre un verre d’eau au soleil !
Comme les chercheurs ont décidé d’utiliser un mécanisme photosynthétique à base de protéines qui se joue dans les membranes cellulaires des plantes, ils ont donc testé différents types de membranes cellulaires comme « intermédiaires » de la réaction : des membranes de cyanobactéries, et des membranes d’épinards (et oui, comme quoi, l’épinard, c’est la vie !). Il a aussi fallu rajouter une pincée de poudre de perlimpinpin, sous la forme de nanoparticules de platine (oui, le métal qui coûte un peu cher…) et une touchette d’ascorbate de sodium (vous le connaissez plutôt sous le nom de E301, l’additif alimentaire), qui agit ici comme un donneur d’électron sacrificiel, c’est à dire qu’on ne le met que parce qu’on a besoin de ses électrons pour que ça marche.
Et la, tadaaaaam ! On éclaire la mixture, et elle nous produit du dihydrogène, jusqu’à ce qu’on soit à court d’ascorbate de sodium !
Pourquoi c’est fabuleux comme résultat ? Tout simplement parce que ça ouvre la porte à une production propre à grande échelle ! Bien sûr, il va falloir faire encore de nombreux tests, et d’abord essayer de trouver un catalyseur un peu moins cher que les nanoparticules de platine si on veut pouvoir produire à des coûts raisonnables, mais en tout cas, les véhicules à hydrogène (à combustion non polluante ! Et qui existent déjà soit dit en passant…) ont de beaux jours devant eux semble-t-il !
